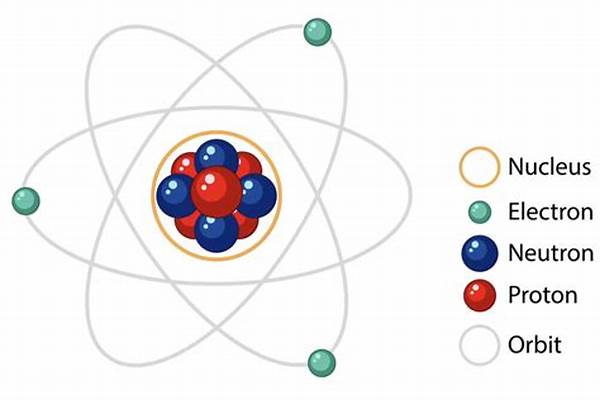
Struktur Atom adalah susunan bagian-bagian yang membentuk sebuah atom. Atom adalah unit dasar dari materi yang terdiri dari tiga jenis partikel subatom: proton, neutron, dan elektron. Struktur atom menentukan sifat kimia dan fisika suatu unsur. Berikut adalah penjelasan lebih rinci tentang struktur atom:
1. Inti Atom (Nukleus):
Inti atom adalah pusat atom yang mengandung proton dan neutron. Inti atom sangat kecil jika dibandingkan dengan ukuran atom secara keseluruhan, tetapi hampir seluruh massa atom terkonsentrasi di sini.
-
Proton:
-
Partikel bermuatan positif (charge +1).
-
Jumlah proton dalam inti menentukan identitas unsur dan disebut nomor atom. Misalnya, atom karbon memiliki 6 proton, sehingga nomor atom karbon adalah 6.
-
-
Neutron:
-
Partikel yang tidak bermuatan (netral).
-
Neutron bersama dengan proton menentukan massa atom. Jumlah neutron dapat bervariasi untuk unsur yang sama, menghasilkan isotop yang berbeda dari unsur tersebut.
-
Contoh: Inti atom karbon (C) memiliki 6 proton dan 6 neutron, sedangkan inti atom karbon isotop 14 (C-14) memiliki 6 proton dan 8 neutron.
2. Elektron:
Elektron adalah partikel bermuatan negatif yang mengorbit sekitar inti atom. Mereka berada di kulit elektron yang berbeda, dengan energi yang bervariasi tergantung pada jaraknya dari inti.
-
Elektron:
-
Partikel bermuatan negatif (charge -1).
-
Elektron mengelilingi inti dalam tingkat energi yang disebut kulit elektron atau orbital.
-
Jumlah elektron dalam atom biasanya sama dengan jumlah proton, sehingga atom bersifat netral secara listrik.
-
Contoh: Pada atom karbon, terdapat 6 elektron yang mengelilingi inti, yang terdistribusi pada dua kulit: 2 elektron di kulit pertama dan 4 elektron di kulit kedua.
3. Kulit Elektron (Tingkat Energi):
Elektron dalam atom tidak tersebar secara acak, melainkan berada di kulit-kulit tertentu. Setiap kulit memiliki tingkat energi yang berbeda, dan semakin jauh kulit dari inti, semakin tinggi energi elektron tersebut.
-
Kulit pertama: Maksimal dapat menampung 2 elektron.
-
Kulit kedua: Maksimal dapat menampung 8 elektron.
-
Kulit ketiga: Maksimal dapat menampung 18 elektron, dan seterusnya.
Elektron akan mengisi kulit dari yang terdekat dengan inti terlebih dahulu, sebelum mengisi kulit yang lebih jauh.
4. Orbital:
Di dalam setiap kulit, elektron tidak tersebar merata, melainkan terdistribusi dalam bentuk orbital. Orbital adalah wilayah di sekitar inti di mana kemungkinan menemukan elektron sangat tinggi. Setiap orbital dapat menampung maksimal dua elektron dengan spin yang berlawanan.
-
Orbital s: Bentuknya bulat, dan terdapat satu orbital s pada setiap kulit.
-
Orbital p: Bentuknya berbentuk dumbbell, dan terdapat tiga orbital p pada kulit yang memiliki nomor kuantum utama n ≥ 2.
-
Orbital d dan f: Tersedia pada kulit dengan n ≥ 3 dan n ≥ 4, masing-masing dapat menampung 5 dan 7 orbital.
5. Model Atom:
Seiring dengan perkembangan ilmu pengetahuan, berbagai model atom telah dikemukakan, antara lain:
-
Model Atom Dalton: Atom adalah partikel terkecil yang tidak dapat dibagi lagi.
-
Model Atom Thomson (model roti kismis): Menyatakan bahwa atom terdiri dari bola bermuatan positif dengan elektron-elektron yang tersebar di dalamnya.
-
Model Atom Rutherford: Menyatakan bahwa atom terdiri dari inti kecil yang bermuatan positif, dengan elektron yang mengelilinginya dalam orbit tertentu.
-
Model Atom Bohr: Menyatakan bahwa elektron mengorbit inti dalam lintasan-lintasan tertentu dengan energi tetap.
-
Model Atom Quantum: Berdasarkan mekanika kuantum, elektron tidak bergerak dalam lintasan pasti, tetapi berada dalam orbital yang menunjukkan probabilitas keberadaannya.
6. Nomor Atom dan Massa Atom:
-
Nomor Atom (Z): Menunjukkan jumlah proton dalam inti atom. Nomor atom menentukan identitas unsur tersebut.
-
Massa Atom (A): Merupakan jumlah proton dan neutron dalam inti atom. Massa atom dapat sedikit berbeda antara isotop dari unsur yang sama, tergantung jumlah neutronnya.
7. Isotop:
Isotop adalah atom-atom dari unsur yang sama dengan jumlah proton yang sama, tetapi jumlah neutron yang berbeda. Ini menyebabkan isotop memiliki massa atom yang berbeda.
-
Contoh: Karbon-12 (C-12) dan karbon-14 (C-14) adalah isotop dari karbon. Keduanya memiliki 6 proton, tetapi C-12 memiliki 6 neutron, sedangkan C-14 memiliki 8 neutron.
Kesimpulan:
Struktur atom terdiri dari inti yang mengandung proton dan neutron, dengan elektron yang mengelilinginya dalam orbit-orbit tertentu. Pengaturan elektron dalam kulit-kulit dan orbital menentukan sifat kimia dan fisika atom. Model atom terus berkembang seiring dengan penemuan baru dalam ilmu fisika dan kimia, yang memungkinkan kita untuk memahami lebih dalam tentang bagaimana atom membentuk materi dan berinteraksi dalam berbagai reaksi kimia.